INSTITUCIÓN EDUCATIVA: SINTRAEMCALI
ÁREA: CIENCIAS NATURALES - QUIMICA
CICLO: CUARTO
DOCENTE: ARMANDO TOVAR CONTRERAS
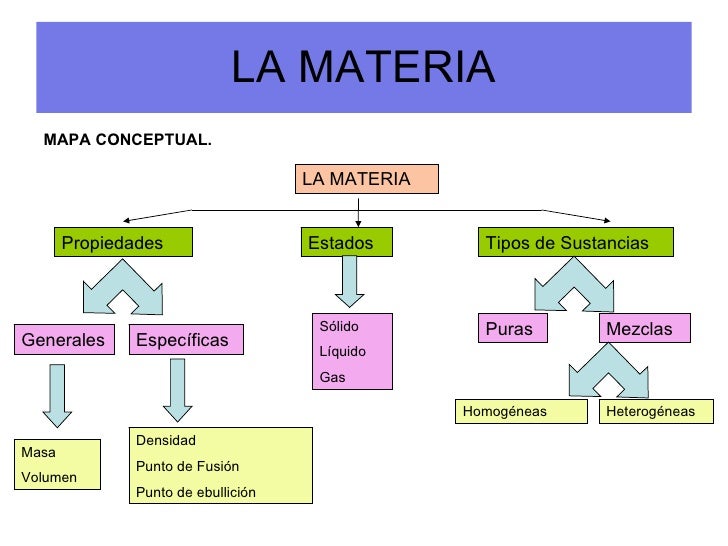
ACTIVIDAD # 1: interpreta con tus propias palabras el anterior mapa conceptual.
ACTIVIDAD # 2: a) Para cada técnica de separación de mezclas, diga en que casos se utiliza y que materiales se emplean.
b) Explica como utilizarías las técnicas necesarias para separar una mezcla de arena y sal.
CAMBIOS FÍSICOS: son aquellos que sufre la materia en su
estado, volumen o forma sin alterar su composición.
NOTA: Cuando los cambios ocurren de izquierda a derecha, la materia se
desorganiza, por que pasa de un estado ordenado como el sólido a un estado caótico
como el gaseoso y esto es debido en parte por aumento de la temperatura.
Al contrario cuando los cambios ocurren de derecha a izquierda, la
materia se organiza, por que pasa de un estado caótico como el gaseoso a un
estado ordenado como el sólido, esto ocurre en parte por disminución en la
temperatura.
ACTIVIDAD # 3:
1. Cual es el estado mas ordenado y cual el mas caótico, explique
2. Explique como se relaciona la temperatura con los cambios de estado
3. Escriba un ejemplo de cada uno de los cambios de estado
4. Escriba la diferencia entre solidificación y punto de congelación; vaporización y punto de ebullición.
Una de las partes que estudia la química es su composición
La composición de una sustancia incluye tanto identidad como la cantidad de sus componentes.
La composición de una sustancia incluye tanto identidad como la cantidad de sus
componentes.
COMPOSICIÓN PORCENTUAL: Uno de los
problemas cotidianos con los que se enfrentan los químicos es determinar la
clase y cantidad de elementos químicos que forman parte de una muestra
analizada y en qué cantidad lo hacen. Los resultados del análisis químico se
reportan como porcentajes de cada elemento presente en la muestra. En este
sentido se llama composición porcentual.
El cálculo
de la composición porcentual a partir de la fórmula molecular es sencillo.
Basta calcular la masa molar y dividir entre ella la masa de cada elemento
presente en la fórmula. Al
multiplicar el resultado por cien se obtiene el porcentaje.
La fórmula
es:
La suma total de cada uno de los
porcentajes en cuanto a composición porcentual debe resultar 100, con un rango
de variación de +/‐ 0.2
De acuerdo al ejemplo podemos concluir que para determinar la composición
de una sustancia se debe:
- Decir qué clase de átomos la forman, es decir su identidad, en el ejemplo anterior diríamos:
Identidad
de la sustancia: Está formada por átomos de H y O
. 2. Composición porcentual de la sustancia: consiste en calcular
el porcentaje de cada componente de la siguiente manera.
Inicialmente en la tabla periódica busco los pesos atómicos de cada
componente y lo multiplico por el subíndice que lo acompaña.
- Para el H, su peso es 1 g,
lo multiplico X 2 porque es el subíndice en la formula = 2 g
- Para el O, su peso es 16 g,
lo multiplico X 1 porque es el subíndice en la formula= 16 g
- Ahora sumo los valores
obtenidos para hallar la masa total: 2 + 16 = 18 g
Finalmente hallo el % de cada componente utilizando los valores que
obtuve anteriormente (2,16 y 18)
Así
% H = 2/18 X 100 = 11. 1%
% O = 16/18 X 100= 88.9%
ACTIVIDAD # 4: Determina la composición para:
a) Cl2O7
b) MnO3 c) H2SO4 d) H3PO4 e) HNO3 f) H2CO3
g) H2Cr2O7
ESTRUCTURA: Indica la forma como
se distribuyen los átomos en una sustancia
Ejemplo:



ACTIVIDAD # 5: Contesta F - V
- Las propiedades químicas se
clasifican en extensivas e intensivas ( )
- Cuando coloco un trozo
de hielo seco (CO2 solido) sobre la mesa ocurre un proceso
llamado fusión por que se derrite ( )
- 10 kilos de hierro
puro tienen la misma densidad que 1 kilo del mismo hierro (
)
- 1 litro de agua ebulle a una
temperatura mayor que medio litro de la misma sustancia
( )
- El hielo seco no tiene punto de fusiona ( )

PARTICULAS SUBATOMICAS
Son las partículas más pequeños encontrados en el átomo.
De las tres partículas subatómicas que nos interesan: protones, neutrones y electrones, dos portan cargas eléctricas. El protón tiene una carga positiva (+), y el electrón porta una carga negativa (-). El neutrón no tiene carga eléctrica, es neutro.
Protón: Posee carga eléctrica positiva numéricamente igual a del electrón, siendo su masa de 1672 X 10 -24 g. El valor de la carga es la unidad fundamental para los fenómenos atómicos y nucleares.
Neutrón: Partícula elemental de masa absoluta 1674.82 10-24 g. Carga eléctrica nula, El núcleo atómico es la diferencia entre el número atómico (número de protones) y el número másico (número total de nucleones).
Electrón: Posee carga eléctrica negativa numéricamente igual a del protón, siendo su masa 9, 11 10-28 g (unas 1836 veces menor que la del protón).
DETERMINACIÓN DE PARTÍCULAS SUBATOMOCAS EN ÁTOMOS NEUTROS
- El número de protones = al número atómico, que se halla en la tabla periódica
- El número de electrones= al número de electrones por ser neutro.
- El número de neutrones= # másico (masa) - número atómico (# de protones).
Ejemplos: Hallemos las partículas subatómicas para el Li
ACTIVIDAD: # 11 Determinar las partículas subatómicas en los siguientes casos
a) Na+ b) N-3 c) S-2 d) Fe2+ e) Sb f) Ca+2 g) Hg
Actividad # 12: Completar el siguiente cuadro acerca de las partículas subatómicas
ISOTOPOS: Átomos que tienen el mismo número atómico pero diferente numero masa, por ejemplo los isotopos del hidrógeno: protio, deuterio y tritio.
1 1H 1 2H 1 3H
protio deuterio tritio
ACTIVIDAD # 13: Escriba cuatro diferencias entre isotopos e isobaros de acuerdo a las definiciones anteriores.
Actividad # 14: Responda falso (F) o verdadero (V)
a) El número atómico es mayor que el número masa en un átomo ( )
b) El número de protones es mayor en los cationes que en el átomo neutro ( )
c) El número de protones no cambia en los cationes ( )
d) El número de electrones en los cationes es menor que en los átomos neutros ( )
e) Un anión tiene menos electrones por eso su carga es negativa ( )
f) El número masa se puede obtener de la tabla periódica a partir de la masa atómica ( )
g) En los isotopos y los isobaros el número de neutrones es diferente ( )
h) En algunos átomos el numero másico es menor que el número atómico ( )
CONFIGURACIÓN O DISTRIBUCIÓN ELECTRÓNICA DESARROLLADA
Al referirnos a la configuración
electrónica (o periódica) estamos hablando de la descripción de la
ubicación de los electrones en los distintos niveles (con subniveles y
orbitales) de un determinado átomo.
Configurar significa "ordenar" o "acomodar", y
electrónico deriva de "electrón"; así, configuración electrónica es
la manera ordenada de repartir los electrones en los niveles y subniveles de
energía.
De
acuerdo al diagrama de las diagonales, el orden de llenado de los subniveles es:
1S, 2S, 2P, 3S, 3P, 4S, 3d, 4P, 5S, 4d, 5P, 6S, 4f, 5d, 6P, 7S, 5F, 6d, 7P
1S, 2S, 2P, 3S, 3P, 4S, 3d, 4P, 5S, 4d, 5P, 6S, 4f, 5d, 6P, 7S, 5F, 6d, 7P
EJEMPLO: Hallar la configuración electrónica para el
Pb
ACTIVIDAD # 15: Hallar
la configuración electrónica desarrollada para los siguientes
átomos
A) 29Cu
B) 53I C) 79Au
D) 20Ca
E) 92U F) 26Fe
G) 47Ag
H) 56Ba
CONFIGURACIÓN ELECTRÓNICA Y
TABLA PERIÓDICA
Para ubicar un elemento químico e la
tabla periódica de acuerdo a su configuración electrónica es necesario primero
obtener su nivel de valencia.
NIVEL DE VALENCIA: es la configuración electrónica
de un átomo a partir de la última S
En nuestro ejemplo para el plomo seria: 6S2
4F14 5d10 6P2
Periodo: es el número que acompaña a la S
en el nivel de valencia.
En nuestro ejemplo el Pb pertenece al periodo
6
GRUPO: Se tiene en cuenta cómo termina
el último subnivel del nivel de valencia y se relaciona de la siguiente manera
S1 = grupo IA o
1 S2 = grupo
IIA o 2
d1 = grupo IIIB o
3 d2 = grupo IVB o 4
d3 = grupo VB o 5 d4 = grupo
VIB o 6 d5 = grupo VIIB o 7
d6 = grupo VIIIB o 8 d7 =
grupo VIIIB o 9 d8 = grupo VIIIB o 10 d9 =
grupo IB o 11 d10 0 grupo IIB o 12
P1 = IIIA o 13
P2 = IVA o 14
P3 = VA o 15
P4 = VIA o 16
P5 = VIIA o 17
P6= VIIIA o 18
4F = Lantánidos
5F = Actínidos.
En nuestro ejemplo el Pb pertenece al grupo IVA o
14
ACTIVIDAD # 16: Ubica en
el respectivo grupo y periodo los elementos del ejercicio # 5
ACTIVIDAD # 18; Evaluación
parcial acerca de las partículas subatómicas y ubicar elemento químico en grupo
y periodo utilizando su nivel de valencia.
ACTIVIDAD # 19: Revisión
de actividades realizadas en clase y de consignación de conceptos de blog
a partir de taller en clase, individual, utilizando el cuaderno como único
recurso de consulta.
PRAES: Comprende que muchos de los problemas de
la contaminación ambiental están relacionados con los procesos químicos que se
llevan a cabo en la vida cotidiana del hombre.
ACTIVIDAD # 20: Escoger una actividad
que realice el hombre y que usted considere que contamina el ambiente, a partir
de ella elaborar un texto de una página donde describa la manera de contaminar,
los efectos en los seres vivos y de qué manera se puede solucionar.
Esta actividad se debe
entregar individual en hojas.
ACTIVIDAD # 21: Evaluación
final de periodo, taller con preguntas de opción múltiple con única respuesta,
acerca de las temáticas vistas durante el periodo.









